

| 項目 目指す研究 赤血球産生因子 Erythropoietin (エリスロポエチン)との出会い 血小板産生因子 Thrombopoietin (トロンボポエチン;TPO, c-Mpl ligand)の発見 TPOとEPO 発見の同時多発 トロンボポエチン受容体作動薬について 様々な動物のTPOとTPO受容体の一次構造 |
<目指す研究> 多くの生物種に共通に存在する重要な細胞、血液細胞(血球)は「幹細胞」を共通の源にして毎日数千億個も造られ、そして破壊されていきます。造血の仕組みの解明は、新たな医療に貢献するとともに、基礎生物学の視点においても大変興味深い研究対象です。当研究室では,個体・細胞・遺伝子・蛋白質を解析対象にして以下の課題に取り組んでいます。 ・どのような分子による、どのような作用により造血が制御されているのか? ・細胞の増殖と分化は,どのような機構で調節されているのか? ・造血を解析するためには,どのような工夫が必要なのか? ・造血の環境応答は? ・脊椎動物(哺乳類,鳥類,爬虫類,両生類,魚類など)の造血幹細胞に共通する性質とは? ・地球上の7万種もの脊椎動物の造血制御系を俯瞰し,普遍性や多様性とは? サイトカイン・インターロイキンなどの分子が関与する造血制御機構を追跡するために、蛋白質化学あるいは分子生物学的手法を活用して、生体を個体・細胞レベルで直接観察しています。私達が現在最も注目しているのは、環境条件によって大きく変動する両生類成体の造血系です。両生類成体の造血研究は世界的に見ても実施例は限られており、正直に申し上げて悪戦苦闘中です。しかし、多様に変貌する、あるいは変動する血球産生に接してみて、解き明かしてみたい事象は山積です。研究対象とする生体因子は造血因子ばかりにとどまらず、造血領域だけにとどまらず、また特定の生物種にとどまらず、生命現象の面白さを調べる様々な機会があります。 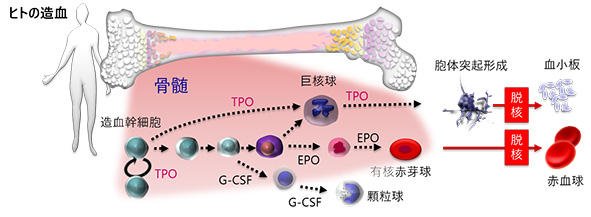 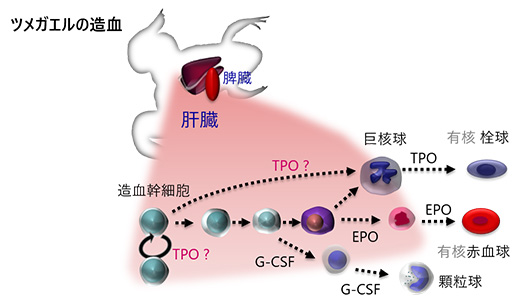 Erythropoitin (EPO), granulocyte colony-stimulating factor (G-CSF), Thrombopoietin (TPO) Aizawa et al. J Biochem, 2005 Nogawa-Kosaka et al. Exp Hematol, 2010 Nogawa-Kosaka et al. J Exp Biol, 2011 Maekawa et al. J Exp Biol, 2013 Okui et al. Cell Tissue Res, 2013 Nagasawa et al. Biol Open, 2013 Nagasawa et al. PlosOne, 2015 Tanizaski et al. Exp Hematol, 2015 Tanizaski et al. Sci Rep, 2015 Okui et al Zool. Sci, 2016 血球や造血の研究成果を見渡してみますと、医療ニーズに直結していたことが主たる理由と思いますが、膨大な科学的知見の集積は、ほとんどがヒト(霊長類)とげっ歯類(マウス・ラット)の場に偏っていることに気がつきます。ところが脊椎動物の殆どは赤血球をもち,閉鎖血管系の損傷に止血機構がはたらき,生体防御のために外敵となる微生物を貪食する血球を持ちます。これらの血球を生産する造血系は,多くの脊椎動物 に共通の基幹システムであるにも関わらず,未知の科学探求の対象と言えるのです。線虫や酵母、ショウジョウバエなどの生物種における科学的検討が、ヒトを含めた生物全体の理解や、創薬の標的分子の発掘に直結した事例は多数あります。ツメガエル(Xenopus) などの両生類,メダカなどの魚類も、広い視点で見ると、一個体にして個体発生 Ontogeny は勿論のこと、系統発生 Phylogeny も再現します。 研究対象の生物種を拡大していくことは、造血を全く新たな視点で見直すきっかけづくりの宝庫であり、比較生物学的視点をもって,未知の制御系の発見を目標にしています。 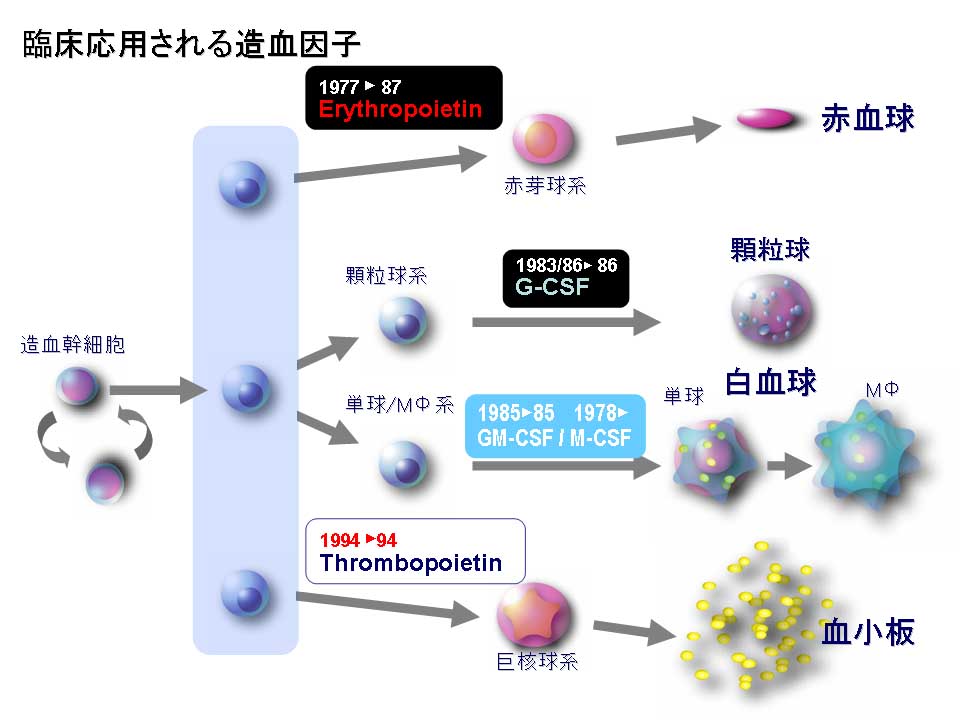 通常、サイトカイン・インターロイキン類の生体内における存在量は、血液1mlあたり数pgから(多くても)数十ng程度であり、極めて微量です。従って、遺伝子発現の追跡や、蛋白質を扱うためには、実験的手法の開発も重要です。特に蛋白質に関しては近年、質量分析法の充実とともにプロテオームの展開が進んできましたが、基本的に「いじればいじるだけ減っていく」分子として、まだまだハンドリング技術や応用技術の深耕が求められています。一方で、細胞の高度解析手法についても将来課題があります。血球細胞などの浮遊系の細胞に発現する分子の解析には、レーザーを用いたフローサイトメトリーの技術が利用されるようになりました。しかし細胞医療や再生医療が一般化する将来へ向けて、この種の技術にはまだまだ技術的な、あるいは経済性について多くの課題があるはずです。私達はこのような課題にも取り組んでいきます。 |
| <赤血球産生因子 Erythropoietin (エリスロポエチン)との出会い> ▲上に戻る 私(加藤)は長年、造血因子の基礎研究と、その応用となる臨床薬の開発を手がけてきました。バイオテクノロジー黎明期に出会った、赤血球産生因子 Erythropoietin (EPO)の基礎・開発研究は当時の私にとって大変衝撃的なものでした。EPOは再生不良性貧血の患者さんの尿中に極微量 に存在する蛋白質です。研究者達はEPOの正体を明かすために大変な研究努力を続けました。EPOの純化はついに宮家隆次博士(熊本大学医学部・シカゴ大学)らによって成し遂げられました(Miyake T, Kung CK, Goldwasser E.: Purification of human erythropoietin. J Biol Chem. 1977)。それまでに多くの研究者がEPOの完全精製に失敗しています。その理由は、1)尿中のプロテアーゼとシアリダーゼの不活化処理に失敗したか、分子の酵素分解の危険性を甘くみていたことこと、2)出発材料となる尿の選別、初期処理を誤ったこと、などが挙げられるかと思います。貴重な尿由来のEPOの精製や分子性状・活性性状の解析には私自身も随分苦労しました。造血細胞の分化と増殖をin vitroで調べる方法に、コロニーアッセイという方法があります。EPOの受容体をもつ非常に未熟な赤血球前駆細胞は、そのままでは他の細胞とは区別が出来ません。EPOを添加して培養をおこない、数日後に出現してくる赤芽球系コロニーの細胞を確認することによって、そこに「非常に未熟な赤血球前駆細胞」があったのだと判定します。この方法は、同時に、EPOの活性を調べる方法にもなります。この手法に頼るとくる日もくる日も根気良く顕微鏡で細胞を観察する日々が続きます。(これで私は近眼の度が進んでしまいました。)精製の成功が報告されたとはいえ、非常に貴重な試料中に極僅かにしか存在しないEPO。誰もがその現実に苦労しました。 1980年代半ばに実用化された気相アミノ酸自動シークエンサーによって、純化されたEPO蛋白質からアミノ酸配列情報が取られ、EPO遺伝子が単離され、そしてなんと、当時勃興した動物細胞を発現宿主とする遺伝子組換え技術の成果を適用することにより、それこそ匙ですくえるほどの「粉」として得ることが出来るようになったのです。それが現実になった時の新鮮な驚愕は、今も忘れることができません。 <血小板産生因子 Thrombopoietin (トロンボポエチン;TPO, c-Mpl ligand)の発見>▲上に戻る その後さらに10年を経て、今度は、長い間の論争を積み残したまま未知であった血小板産生因子 Thrombopoietin (TPO, c-Mpl ligand)の純化と全構造の解明に辿り着きました。それは当時勤務していたキリンビールの研究所の仲間達と10年以上も悪戦苦闘を続けた結果でした。新しい分子を手中にすると様々な現象の説明が可能となります。TPOの登場によって、基礎・臨床の多数の方々に助けられながら(今も、これは同様です)、巨核球・血小板の産生・機能などの研究をはじめ、当初は思いもよらなかった血液幹細胞領域などへ波及する研究などが可能となり、発見研究 Discovery Research の醍醐味を実感しました。 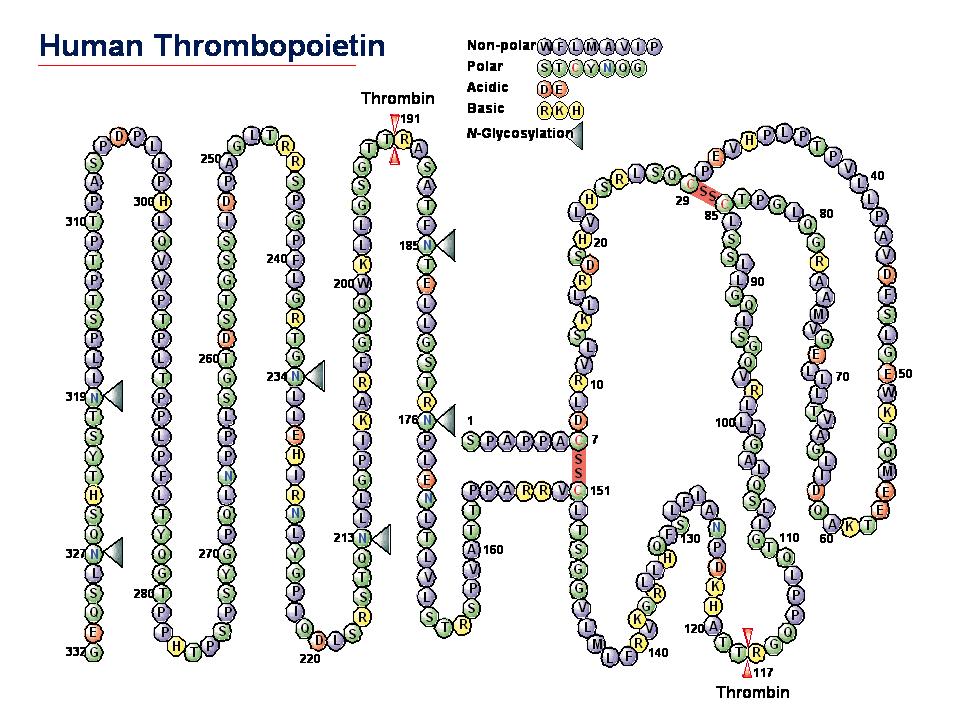 Kato T, et al.J Biochem 118(1):229-236 (1995) Sohma Y, et al. FEBS Lett 10;353(1):57-61 (1994) Kato T, et al. Proc Natl Acad Sci USA 94(9):4669-4674 (1997) Kato T, et al. Stem Cells 16 (suppl 2):11-19; Reprinted in Stem Cells 16(5):322-328 (1998). <TPOとEPO> ▲上に戻る ヒトのTPOのN末端側領域(受容体結合領域)とEPOの一次構造(アミノ酸配列)の24%は完全一致し,類似性は36%にもなります。しかし興味深いことに造血作用はそれぞれ独立しており,それぞれは血小板産生,赤血球産生の系譜に特異的に作用します。両者ともX線結晶構造が解かれ,成長ホルモン,レプチンなどと同様の4α-バンドル構造をもちます。しかし生理活性上,重要な機能をもつ糖鎖付加に大きな違いがあり,TPOのN末端側領域にN結合型糖鎖は無い一方で,C末端側領域には6か所ものN結合型糖鎖が付加されています。これに対してEPOのN結合型糖鎖は3か所です。下図はこれらの分子構造の概要を図にしたものです。 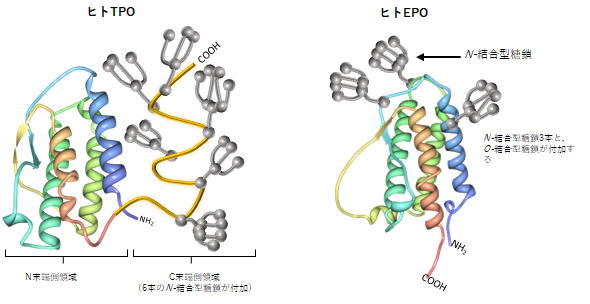 <発見の同時多発>▲上に戻る ところが私達以外にも,米国の4つの研究グループがそれぞれ全く異なる動物材料と実験手法を適用して,TPO分子の同定に成功しました。期せずして,少なくとも哺乳類5種はTPOとその受容体c-Mplをもち,巨核球や巨核球前駆細胞に作用して血小板産生を担うことが証明されたのです。この現実を喜ぶべきか,悲しむべきか,複雑な思いがありましたし,いきなり始まった研究競争の中で様々な出来事がありました(→※)。私達は後で知ったのですが,我が国でも私達以外に少なくとも5つの企業や研究機関でTPOを探索していたとのことです。しかし,まさか海の向こうでも同時にTPOが同定されることなどは想像だにせず,想定外の出来事でした。そして間髪を入れず,血小板減少症の治療薬として遺伝子組換えTPOの開発競争が勃発しました。 (※)宮崎洋, 加藤尚志:“トロンポポエチン研究の歴史とクローニング,トロンポポエチンの基礎を知る”,池田康夫(編)“トロンボポエチン受容体作動薬のすべて”,先端医学社,2012. 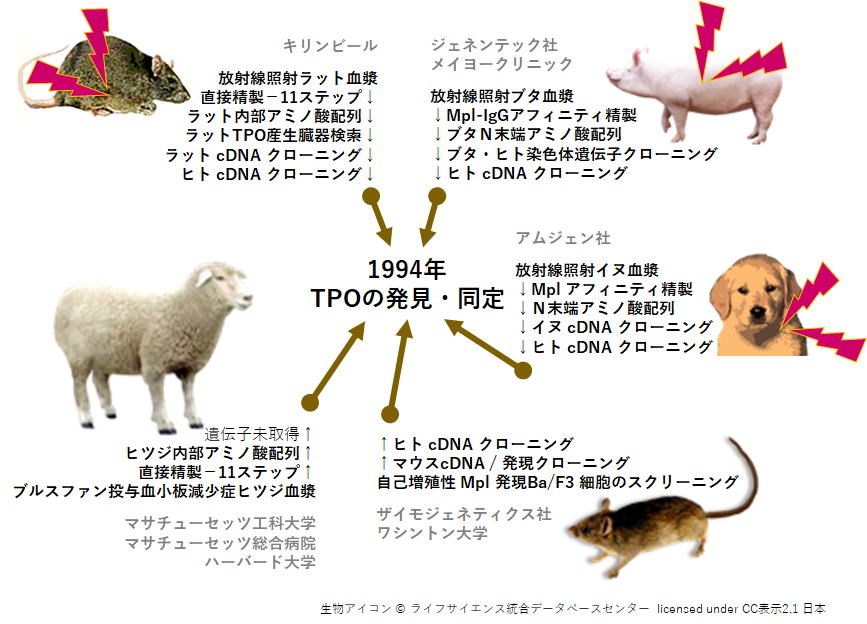 < トロンボポエチン受容体作動薬について> ▲上に戻る 血小板減少症治療薬として,TPOのN末端領域の遺伝子組換え体にポリエチレングリコール(PEG)を結合させたPEG-rHuMGDFと,CHO細胞で発現させた組換えヒトTPO(rhTPO)の臨床試験が全世界で進められました。これらの天然の分子構造を含む遺伝子組換えTPO製剤は第一世代と呼ばれています。しかし血小板産生能が実証されながらも,これらの製剤の投与により抗体産生例が発生し,特にPEG-rHuMGDFでは内因性TPOを中和してしまう抗体が出現したため,臨床試験は中止になりました。本来,遺伝子組換え分子は天然のアミノ酸配列をもつため,抗体産生は回避されること,PEGの付加は必ずしも異物と認識されるわけではなく,中和抗体産生の機序は不明のままです。その後,受容体に結合して血小板前駆細胞に血小板産生刺激シグナルを入れる第二世代の薬剤開発が勃発し,人工ペプチド,非ペプチド性低分子化合物,アゴニストモノクローナル抗体などのTPOミメティクス(模倣分子)が続々と登場しました。これらを「TPO受容体作動薬」と呼びます。現在,臨床薬となっているのは,米国で2008年,日本で2011年に承認された皮下注射剤ロミプロスチム(romiplostim)と,米国で2008年,日本で2010年に承認された低分子経口剤エルトロンボパグ(eltrombopag,SB-497115)です。 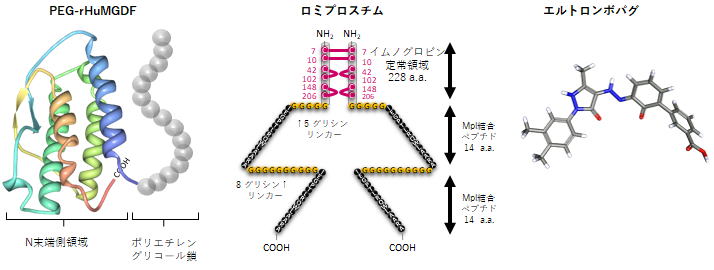 Kato T, A. Matsumoto, K. Ogami, et al. Stem Cells, 1998 Kato T. Hematopoietic Growth Factors. In:Handbook of Hormones, Elsevier, 2015 Kuter D.J. Blood, 2007 Kuter D.J., Begley C.G. Blood, 2002 Molineux G. Ann N Y Acad Sci, 2011 <様々な動物のTPOとTPO受容体の一次構造> ▲上に戻る 今日,遺伝子配列データベースには現在までに80種を超える生物において,TPOやTPO受容体の相同分子を見出いだすことができます。しかし一次構造上の類似性は必ずしも高いわけではありません。また,TPOとTPO受容体が結合する領域の保存について立体構造を調べたり,それぞれの生物種では造血活性以外にも生理機能があるのではないか,という疑問の解明を目指して探求を進めています。 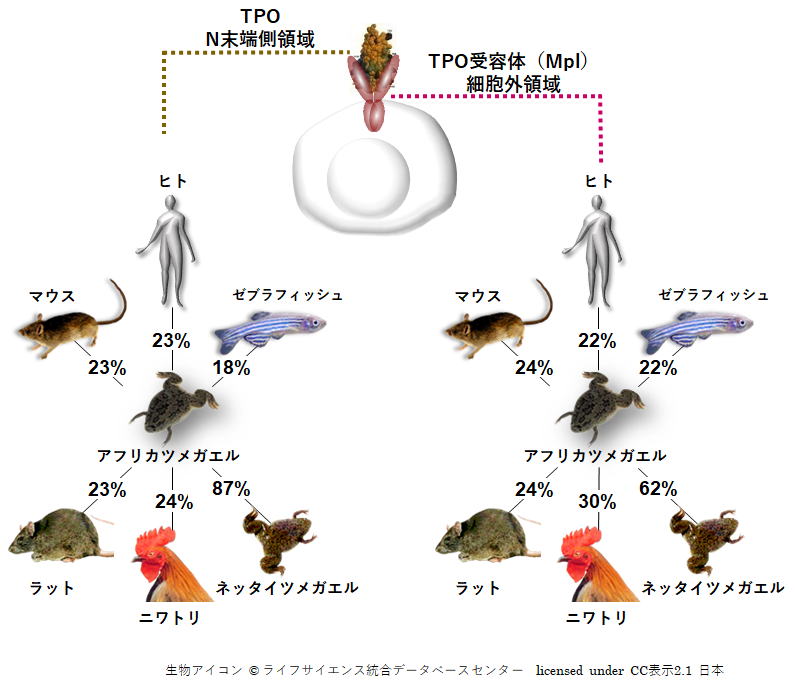 |
| 詳細な内容については公開準備中です。 取敢えず、「研究報告会」「主催セミナー」のページをご参考下さい。 お急ぎの方は 直接、e-mail/FAXにて加藤尚志 までお問合せ下さい。  |